目录
快速导航-
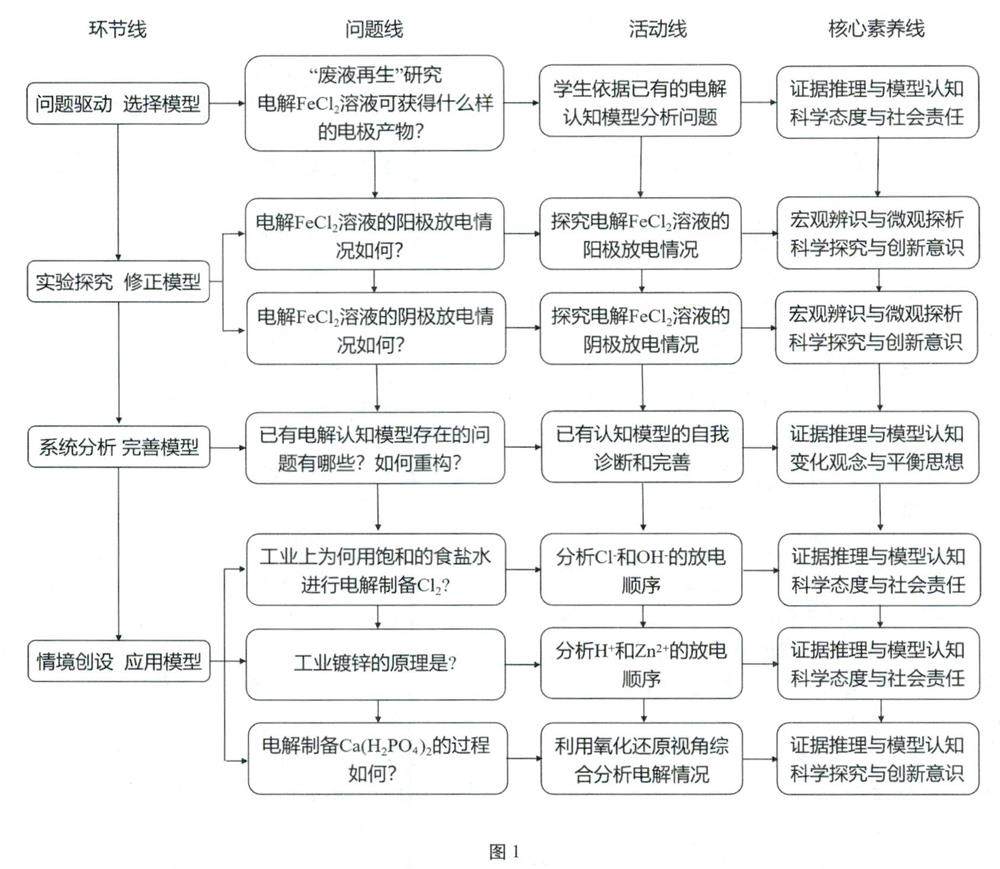
教学研究 | 基于“证据推理与模型认知”的化学课堂教学实践探索
教学研究 | 基于“证据推理与模型认知”的化学课堂教学实践探索
-

教学研究 | 真实情境下的教学:探析化学符号的三重意义
教学研究 | 真实情境下的教学:探析化学符号的三重意义
-

教学研究 | 基于真实情境“工业脱硫法”的二氧化硫教学设计
教学研究 | 基于真实情境“工业脱硫法”的二氧化硫教学设计
-
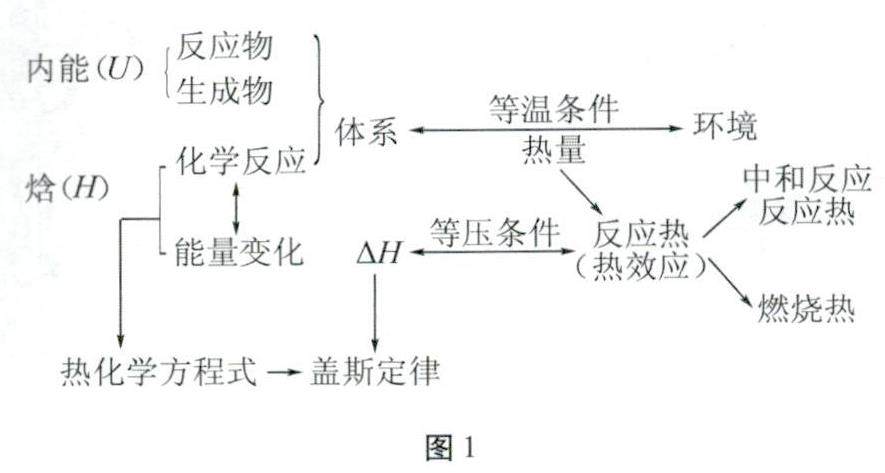
教学研究 | 基于证据推理促进化学概念深度学习
教学研究 | 基于证据推理促进化学概念深度学习
-

教学研究 | 基于实践层面的学科大概念进阶及提炼初探
教学研究 | 基于实践层面的学科大概念进阶及提炼初探
-
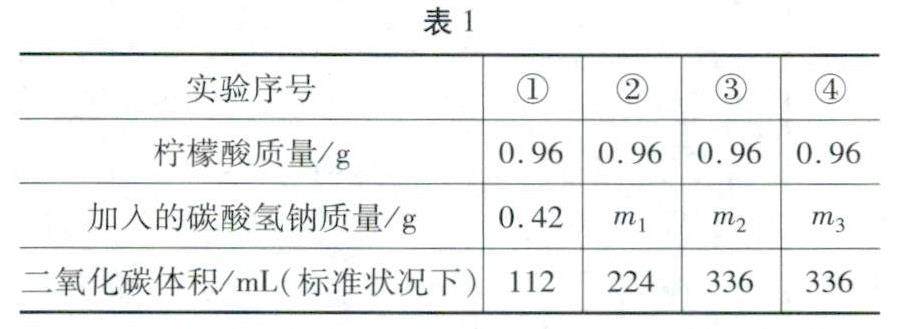
学习园地 | 中考化学表格信息的分类
学习园地 | 中考化学表格信息的分类
-
学习园地 | “盐的性质”复习指要
学习园地 | “盐的性质”复习指要
-
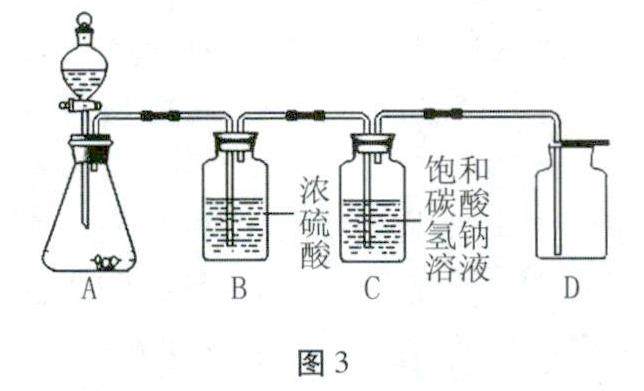
学习园地 | 常见气体的制取和净化的考查类型
学习园地 | 常见气体的制取和净化的考查类型
-

学习园地 | 例析氢氧化钠变质的检验方法
学习园地 | 例析氢氧化钠变质的检验方法
-
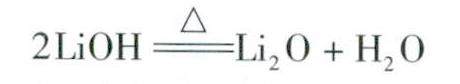
学习园地 | “金属及其化合物”中的不一定
学习园地 | “金属及其化合物”中的不一定
-

备课札记 | “化学反应速率”知识扫描
备课札记 | “化学反应速率”知识扫描
-
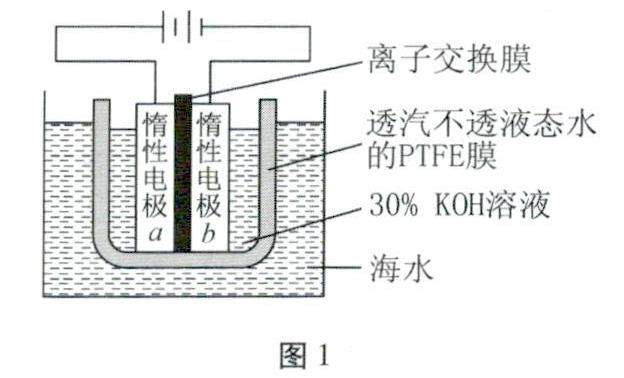
备课札记 | 电解池阴阳极的判断方法
备课札记 | 电解池阴阳极的判断方法
-

备课札记 | 多角度突破物质的量的计算
备课札记 | 多角度突破物质的量的计算
-
备课札记 | 直击元素周期律的学习
备课札记 | 直击元素周期律的学习
-

备课札记 | “卤代烃”知识概要
备课札记 | “卤代烃”知识概要
-

方法与技巧 | 水溶液中离子平衡的图像分析
方法与技巧 | 水溶液中离子平衡的图像分析
-
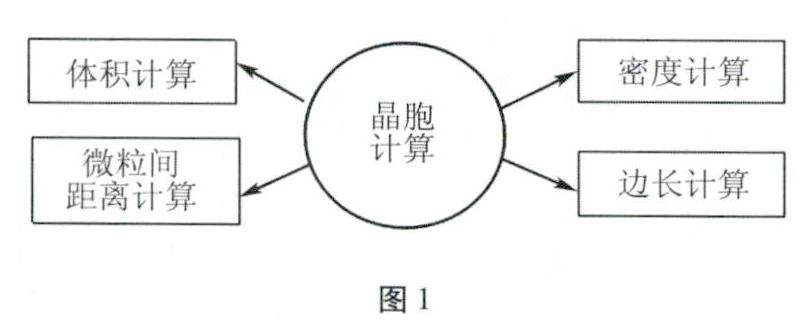
方法与技巧 | 结构化学热点“晶胞计算”的几何解法
方法与技巧 | 结构化学热点“晶胞计算”的几何解法
-

方法与技巧 | 化学平衡常数几个解题技巧
方法与技巧 | 化学平衡常数几个解题技巧
-

试题研究 | 核心素养下的图像分析题探究
试题研究 | 核心素养下的图像分析题探究
-
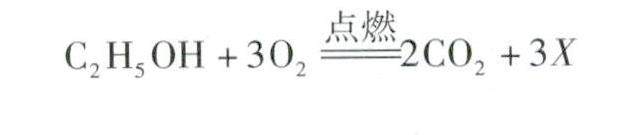
试题研究 | 解析质量守恒定律的考查方式
试题研究 | 解析质量守恒定律的考查方式
-

复习与练习 | 高考工艺流程题中反应条件的控制
复习与练习 | 高考工艺流程题中反应条件的控制
-

复习与练习 | 聚焦盐类水解 破解十大应用
复习与练习 | 聚焦盐类水解 破解十大应用
-

复习与练习 | 例析电离常数的应用
复习与练习 | 例析电离常数的应用
-

复习与练习 | 巧用假想中间态模型解答平衡中比较类问题
复习与练习 | 巧用假想中间态模型解答平衡中比较类问题
-
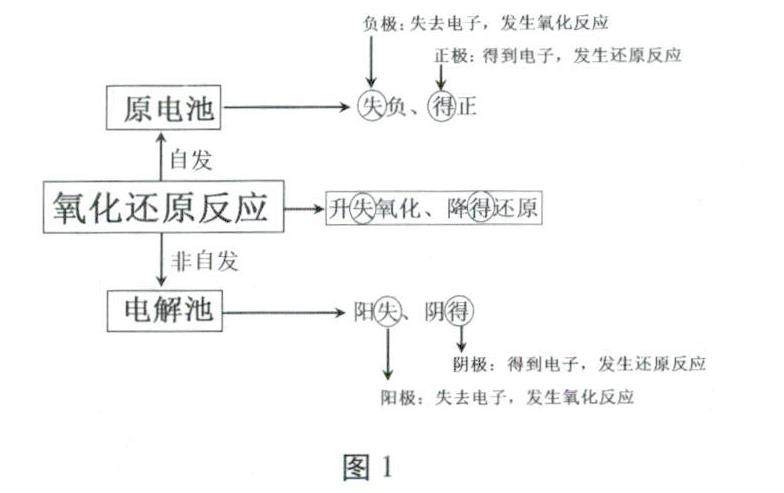
复习与练习 | 基于思维模型构建的高三电化学复习难点突破策略
复习与练习 | 基于思维模型构建的高三电化学复习难点突破策略


















 登录
登录